
Atom ölçeğinde farklı türdeki tanecikler (örneğin: atom, iyon, molekül, radikal) arasında farklı etkileşimler ortaya çıkabilir. Bu etkileşimleri kimyasal türler arası güçlü etkileşimler ve kimyasal türler arası zayıf etkileşimler olarak sınıflandırabiliriz.
Kimyasal türler arası güçlü etkileşimler bir molekülü oluşturan atomları bir arada tutan kuvvetler yani kimyasal bağlardır. Kimyasal türler arası zayıf etkileşimler ise moleküller arasında ortaya çıkan kuvvetlerdir.
Van Der Waals Kuvvetleri
Moleküller arası etkileşimler ilk defa Hollandalı fizikçi Johannes van der Waals tarafından 1873 yılında tamamladığı doktora tezinde kuramsal olarak ortaya kondu. Bu nedenle moleküller arasındaki etkileşimler Van Der Waals kuvvetleri olarak bilinir.
Van der Waals kuvvetlerinin farklı türleri vardır. Dipol-dipol etkileşimleri olarak isimlendirilen moleküller arası etkileşim türü, polar bir molekül ile başka bir polar molekül arasında oluşur.
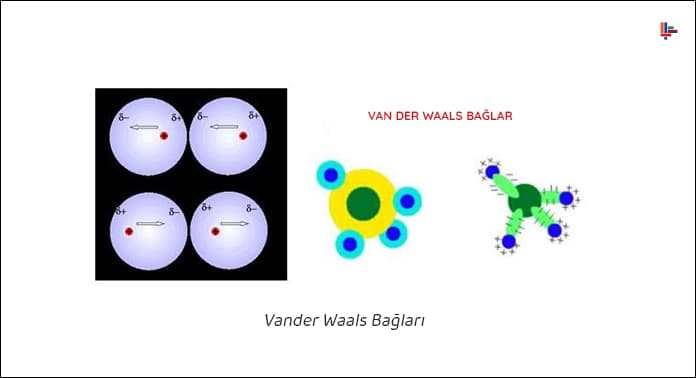
Van der Waals kuvveti veya Van der Waals etkileşimi, fiziksel kimyada kovalent bağlar, hidrojen bağları ve iyonların birbiriyle, nötr moleküllerle veya elektrik yüklü moleküllerle elektrostatik etkileşimi hariç olmak üzere, moleküller arasındaki (veya aynı molekül parçalarının arasındaki) çekici veya itici güçlerin toplamıdır. Hollandalı bilim insanı Johannes Diderik van der Waals’ın adını taşımaktadır.
İdeal gaz yasasında bazı değişiklikler yaparak parçacıklar arasındaki etkileşimleri ve parçacık hacimlerini denkleme dahil edebilir, böylece gerçek gazların davranışlarını daha doğru tanımlayan bir denklem elde edebiliriz. Bu denklem Van der Waals denklemi olarak bilinir ve gazların ideal olmayan koşullardaki özelliklerini hesaplamak için kullanılabilir.
Van Der Waals Bağı:
Pozitif olarak yüklenmiş molekülün bir kısmı ve negatif olarak yüklenmiş ikinci molekülün bir kısmı arasındaki kısa süreli zayıf çekim kuvvetidir. Molekülde elektronların fazla olduğu taraf kısmen negatif, diğer taraf da kısmen pozitif yükle yüklenir. Pozitif ve negatif yüklü kısımlar, arasındaki kuvvetlerin etkisi ile moleküller arasında oluşur. Bu bağlara van der waals bağları denir.
Oda şartlarında gaz halindeki bazı apolar moleküller soğutulur ve yüksek basınç uygulanırsa molekülleri birbirine yaklaşır. Böylece ikincil bir bağ olan van der waals bağları oluşur. Moleküler maddelerin molekül büyüklüğü arttıkça hem zayıf olan bu bağın kuvveti artar, hem de kaynama ve erime noktaları yükselmektedir.

(Johannes Diderik van der Waals 23 Kasım 1837-23 Kasım 1837)
Gelecekteki Nobel ödüllü, 23 Kasım 1837’de Hollanda’nın Leyden kentinde Jacobus van der Waals ve Elisabeth van den Burg’un on çocuğundan ilki olarak doğdu. O zamanlar, kızlar ve işçi sınıfı erkek çocuklarının sıkı bir orta öğretime erişimi yoktu. İlköğretimini doğduğu yerde bitirdikten sonra öğretmen oldu. Klasik diller hakkında bilgisi olmamasına ve bu nedenle akademik sınavlara girmesine izin verilmemesine rağmen, 1862-65 yılları arasında boş zamanlarında Leyden Üniversitesi’nde okumaya devam etti. Bu sayede matematik ve fizik öğretmenliği sertifikaları da aldı.
Van der Waals, ilkokul öğretmeni olarak çalışmak için 14 yaşında okulu bıraktı ve sonunda 24 yaşında bir ilkokulun müdürü oldu. Daha fazla bilgiye aç olduğu için, boş zamanlarında yerel Leyden Üniversitesi’nde matematik, fizik ve astronomi derslerine katıldı, ancak Latince bilgisini zorunlu kılan giriş koşulları göz önüne alındığında, tam zamanlı bir öğrenci olarak kaydı defalarca reddedildi. Hollanda orta öğretim sistemini genişleten kapsamlı eğitim reformlarının ardından van der Waals, kendisini ortaokul öğretmeni olma hedefine adadı ve nihayetinde on yıldan fazla bir süredir fizik öğretmeni olarak çalıştı.
Van der Waals’ın dünyası, Hollanda eğitim politikasındaki bir başka değişikliğin Latince’nin üniversiteye kabul şartını kaldırmasıyla açıldı. Van der Waals, fizik ve matematik yeterlilik sınavlarını hızla geçti ve Leyden Üniversitesi’nde doktora çalışmalarına başladı. 1873’te 36 yaşında nihayet doktora derecesini aldı.
1876’da Amsterdam’ın eski Athenaeum İllustre’sini üniversite statüsüne yükselten yeni Yüksek Öğretim Yasası kurulduğunda, Van der Waals ilk Fizik Profesörü olarak atandı. Genetikçi Van’t Hoff ve Hugo de Vries ile birlikte Üniversitenin şöhretine katkıda bulundu ve başka yerlerden gelen davetlere rağmen emekli olana kadar ona sadık kaldı.
Van der Waals’ın tezinin konusuna olan ilgisinin hemen nedeni, R. Clausius’un ısıyı bir hareket olgusu olarak gören incelemesiydi ve bu da onu T. Andrews’un gazlarda “kritik sıcaklıkların ” varlığını ortaya çıkaran deneyleri (1869) için bir açıklama aramaya yöneltti. Gazların ve sıvıların basıncı, hacmi ve sıcaklığı arasındaki ilişkiyi kurarken moleküllerin hacimlerini ve moleküller arası kuvvetleri (şimdi genel olarak adlandırıldıkları gibi “Van der Waals kuvvetleri”) hesaba katmanın gerekliliğini görmesini sağlayan Van der Waals’ın dehasıydı.
İkinci bir büyük keşif çok zorlu çalışmalardan sonra geldi.1880’de İlgili Devletler Yasasını ilan ettiğinde yayınlandı. Bu, basıncın kritik basıncın basit bir fonksiyonu, hacmin kritik hacimden biri ve sıcaklığın kritik sıcaklıktan biri olarak ifade edilmesi durumunda, tüm maddeler için geçerli olan durum denkleminin genel bir formunun elde edildiğini gösterdi, çünkü üç sabit a, b ve R belirli bir maddenin kritik miktarlarında ifade edilebilen denklemde kaybolacaktır. Deneyler sırasında nihayetinde 1898’de J. Dewar tarafından hidrojenin ve 1908’de H. Kamerlingh Onnes tarafından helyumun sıvılaşmasına yol açan bir kılavuz görevi gören bu yasaydı. 1913’te düşük sıcaklık çalışmaları ve sıvı helyum üretimi nedeniyle Nobel Ödülü’nü alan ikincisi, 1910’da “Van der Waals’ın çalışmalarının deneyler yapmak için her zaman sihirli bir değnek olarak görüldüğünü ve Leyden’deki Kriyojenik Laboratuvarın teorilerinin etkisi altında geliştiğini ” yazdı “.
1890’da, Van der Waals’ın bir başka büyük başarısı olan Néerlandaises Arşivlerinde “İkili Çözümler Teorisi” üzerine ilk inceleme yayınlandı. Durum denklemini Termodinamiğin ikinci Yasası ile ilişkilendirerek, ilk olarak W. Gibbs tarafından heterojen maddelerin dengesi üzerine yaptığı incelemelerde önerdiği biçimde, matematiksel formülasyonlarının bir yüzey biçiminde grafiksel bir temsiline varmayı başardı.
Onuruna “Psi-yüzey” adını verdi Yunan harfini seçen Gibbs’in Psi denge için önemli olduğunu fark ettiği serbest enerjinin sembolü olarak. İkili karışımlar teorisi, kritik fenomenlerin özelliklerini teori tarafından tamamen tahmin edilebilir bulan J. P. Kuenen tarafından gerçekleştirilen ilk deneylerden biri olan çok sayıda deney dizisine yol açtı. Bu konudaki dersler daha sonra Van der Waals ve Ph. Kohnstamm tarafından Lehrbuch der Thermodynamik’te (Termodinamik ders kitabı) toplandı.
Van der Waals’ın temel haliyle ilk olarak 1893’te ortaya çıkan termodinamik kılcallık teorisinden de bahsedilmelidir. Bunda, sıvı ile buhar arasındaki sınır tabakasında kademeli, ancak çok hızlı bir yoğunluk değişiminin varlığını kabul etti. Sıvının yoğunluğunun buharın yoğunluğuna ani bir geçişini varsayan Gibbs’inkinden farklı bir görüş. Van der Waals, daha önce bu fenomenler üzerine bir teori oluşturmuş olan Laplace’ın aksine, moleküllerin kalıcı, hızlı hareket halinde olduğu görüşüne de sahipti. Kritik sıcaklığa yakın olaylarla ilgili deneyler, Van der Waals’ın kavramları lehine karar verdi.
Van der Waals, aşağıdakilerden özellikle bahsedilmesi gereken çok sayıda onur ve ayrımın sahibiydi. Cambridge Üniversitesi fahri doktorasını aldı; Moskova İmparatorluk Doğa Bilimcileri Derneği, İrlanda Kraliyet Akademisi ve Amerikan Felsefe Derneği’nin onursal üyesi oldu; Institut de France ve Berlin Kraliyet Bilimler Akademisi’nin ilgili üyesi; Belçika Kraliyet Bilimler Akademisi’nin yardımcı üyesi ve Londra Kimya Derneği, ABD Ulusal Bilimler Akademisi ve Roma Accademia dei Lincei’nin yabancı üyesi.
Van der Waals kuvveti veya Van der Waals etkileşimi, fiziksel kimyada kovalent bağlar, hidrojen bağları ve iyonların birbiriyle, nötr moleküllerle veya elektrik yüklü moleküllerle elektrostatik etkileşimi hariç olmak üzere, moleküller arasındaki (veya aynı molekül parçalarının arasındaki) çekici veya itici güçlerin toplamıdır.

- İki daimi dipollerarasındaki kuvvet (Keesom kuvveti)
- Bir daimi dipol ve buna karşılık gelen bir indüklenmiş dipol (Debye kuvveti)
- Aynı anda indüklenmiş iki dipol arasındaki kuvvet (London dağılım kuvveti).
Bir atomun elektronunun belirli bir zamanda elektron bulutunda belirli bir alanda bulunma olasılığına “elektron yük yoğunluğu” denir. Elektronun tam olarak nerede olduğunu bilmenin bir yolu olmadığından ve hepsi zamanın %100’ünde aynı bölgede kalmadıklarından, elektronların hepsi aynı alana aynı anda giderse, anlık olarak bir dipol oluşur. Bir molekül polar olmasa bile, elektronların bu yer değiştirmesi polar olmayan bir molekülün bir an için polar olmasına neden olur.
Molekül polar olduğu için bu, tüm elektronların bir ucunda yoğunlaştığı ve molekülün o uçta kısmen negatif yüklü olduğu anlamına gelir. Bu negatif uç, çevredeki moleküllerin anlık bir dipole sahip olmasını sağlayarak çevredeki moleküllerin pozitif uçlarını da çeker. Bu süreç, “Londra Dağılım Çekim Kuvveti” olarak bilinir.
Bir molekülün polar olma ve elektronlarının yerini değiştirme yeteneği, molekülün “polarizabilitesi” olarak bilinir. Bir molekül ne kadar çok elektron içeriyorsa, polar olma yeteneği o kadar yüksek olur. Polarize edilebilirlik, periyodik tabloda bir grubun tepesinden alta ve dönemler içinde sağdan sola doğru artar. Bunun nedeni, molekül kütlesi ne kadar yüksek olursa, bir atomun sahip olduğu elektronların o kadar fazla olmasıdır. Daha fazla elektronla, dış elektronlar kolayca yer değiştirir çünkü iç elektronlar çekirdeğin pozitif yükünü normalde çekirdeğe yakın tutacak olan dış elektronlardan korur.
Moleküller polar hale geldiğinde erime ve kaynama noktaları yükselir çünkü bu bağların kopması daha fazla ısı ve enerji gerektirir. Bu nedenle, kütle ne kadar büyükse, o kadar fazla elektron bulunur. Fazla elektron olmasıyla, bu maddelerin erime ve kaynama noktaları o kadar yüksek olur.
Londra dağılım kuvvetleri, kompakt olmayan, ancak uzun element zincirleri olan moleküllerde daha güçlüdür. Bunun nedeni, çekirdekteki elektronlar ve protonlar arasındaki çekim kuvvetlerinin daha zayıf olması nedeniyle elektronların yer değiştirmesinin daha kolay olmasıdır. Elektronların daha kolay yer değiştirmesi, molekülün aynı zamanda daha “polarize edilebilir” olduğu anlamına gelir.
Van der Waals’ın “Gaz ve Sıvı Halin Sürekliliği Üzerine” tezi, modern termodinamiğin temellerini oluşturdu ve sonunda 1910 Nobel Fizik Ödülü’ne yol açacaktı. İçinde, van der Waals denklemi olarak bilinen şeyde hem gazların hem de sıvıların özelliklerini tanımlamak için birleşik bir model önerdi: (P + a/V 2) (V − b) = RT, burada P, V ve T, van der Waals denkleminin basıncı, hacmi ve sıcaklığıdır. Bir madde ve a ve b sabitlerdir.
Van der Waal’ın çalışmasının önemi, İdeal Gaz Yasasını (PV = nRT) molekülleri ve moleküller arası kuvvetleri barındıracak şekilde uyarlamakta yatmaktadır.
Termodinamik alanında bir dev olan James Clerk Maxwell, van der Waal’ın Nature tezinin ileri görüşlü bir incelemesinde,”Van der Waals’ın adının yakında moleküler bilimde en önde gelenler arasında olacağına şüphe yok” dedi. Bu erken övgüye rağmen, van der Waal’ın başarısının tanınması yavaş geldi. Büyük ölçüde eser ilk olarak yalnızca Hollandaca olarak yayınlandı. Van der Waal’ın bulgularının çok okunan Almanca Annalen der Physik dergisinde özetlendiği 1877 yılına kadar, fizik camiasının bu çalışmanın devrimci doğasını tam olarak kavraması, sıvıların ve gazların moleküler fiziği üzerine bir araştırma faaliyeti telaşını tetiklemesi sürdü.
Bu başarılara rağmen, van der Waals alçakgönüllülüğüyle ünlüydü. Bu belki de en belirgin olanı Nobel Ödülü konferansının açılış sırasındadır: “Artık gazların ve sıvıların doğası hakkındaki teorik çalışmalarımdan bahsetmek için bu seçkin toplantıdan önce görünme ayrıcalığına sahip olduğuma göre, kendimden ve kendi çalışmalarımdan bahsetmek için çekingenliğimin üstesinden gelmeliyim.” demiştir.
Van der Waals Denklemi Van der Waals denklemi, gerçek bir değeri hesaplamak için kullanılan ideal olmayan (gerçek) gazlar gibi özel durumlar için gereklidir.
Denklem şunlardan oluşur:
Formüldeki;
P: normal durumlardan daha düşük olması beklenen ölçülen basıncı temsil eder.
V: mol cinsinden gaz hacmini ifade eder.
n: Moleküller arası çekim kuvvetleri, aşağıdakilerle denkleme dahil edilir:
a: Belirli bir gazın belirli bir değeri olduğu terim.
b: değişkeni, gaz moleküllerinin hacmini oluşturan ve aynı zamanda belirli bir gazın değeri olan mol başına elimine edilen hacmi ifade eder.
R: bilinen bir sabittir, 0.08206 L atm mol – 1 K-1‘dir
T: sıcaklık anlamına gelir.
Gerçek veya ideal gazların hesaplanmasında kullanılan çoğu denklemin aksine, van der Waals denklemi, katılan moleküllerin hacmini ve moleküller arası çekim kuvvetlerini dikkate alır ve düzeltir.

Gecko Kertenkelesi ve Van der Waals Etkileşimi
Van der Waals etkileşimi oldukça zayıftır, sadece atomlar ya da moleküller birbirine çok yakın olduğunda gerçekleşir. Fakat bu şekilde çokça etkileşimin bir anda oluşması oldukça güçlü bir bağ oluşturabilir.
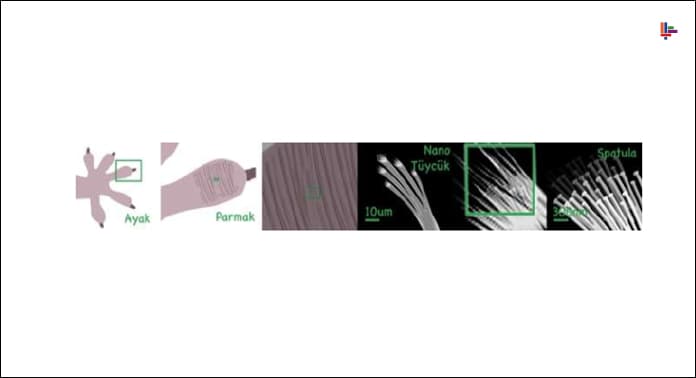
Gecko kertenkelesi Van der Waals bağları yardımıyla bir dik yüzeyleri tırmanabilmektedir. Gecko kertenkelesinin ayaklarındaki çok sayıdaki minuskul boyuttaki saçımsı çıkıntılar ve güçlü tendonları sayesinde yüzeyle ayaklar arasında maksimum temas ve sertlik sağlanır. Ayaktaki moleküller ve duvar yüzeyi arasında oluşan çok sayıdaki Van der Waals etkileşimi hep birlikte oldukça güçlü bir bağ oluşturur ve Gecko’nun vücut ağırlığını dengeler.
Bu örnekten etkilenilerek Geckskin isimli yapıştırıcı, ABD’de bulunan Massachussetts Üniversitesi tarafından icat edilmiştir.
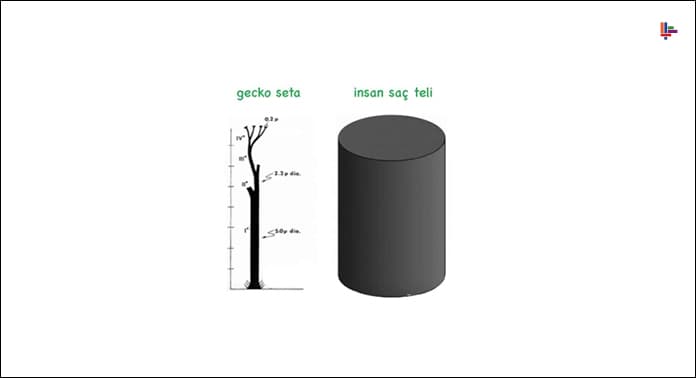
Gecko kertenkelelerinin ayaklarında “Seta” adı verilen yüz binlerce tüycük bulunur. Her seta yaklaşık 1mm uzunluğunda ve 5 µm çapındadır.
‘Seta’lar “200nm uzunluğunda ve 10nm çapından daha küçük tüycüklerle kaplıdır”. “Bu tüycükler insan saçından 10 kat daha incedir ve mikroskop altında uçlara doğru çatallandığı ve daha da inceldiği görülür. Bu tüycüklerin uçları o kadar incedir ki kertenkelenin tutunduğu yüzey ile moleküler düzeyde bir etkileşim sağlanır.”
Moleküler etkileşim nedeniyle ortaya çıkan kuvvet Van Der Waals kuvvetidir. Van der Waals kuvvetleri moleküller veya atomlar arasında elektronların anlık dizilimlerinden meydana gelen geçici kuvvetlerdir. Diğer kimyasal bağlara göre çok daha zayıftır. Bu kuvvet her ne kadar zayıf da olsa geckoların ayaklarındaki “2 milyon tüycüğün” her biri geckonun duvara tutunmasına destek olur. Bu tüycüklerin esnekliği yüzey alanını dolayısıyla çekim kuvvetini (adsorpsiyon) arttıran bir başka etkidir.
Geckoların tırmandıkları yüzeye hızlıca yapışıp hızlıca ayrılabilmeleri Van der Waals bağlarının hızlıca kurulup yok olmasıyla gerçekleşir. Bu bilgilerden yola çıkarak gecko kertenkeleleri yalnızca geçici fiziksel kuvvetler sayesinde duvara, cama hatta ıslak yüzeylere bile tırmanabildiklerini söyleyebiliriz.
Bilim insanları gecko kertenkelelerini bu olağanüstü özelliklerini taklit eden teknolojiler geliştirmeye çalışmaktadırlar. Kertenkelelerinin ayaklarındaki doğal tüycükleri nanoteknoloji ile sentetik olarak üretip aynı çekim kuvvetine sahip maddeler üretmeyi başarmışlardır.

Ne var ki üretilen nano materyallerin üretim maliyeti yüksek dayanıklılığı ise düşüktür. Ayrıca ıslak zeminlerde çekim gücünü yitirmektedir. “Yapay gecko ayaklarında 600nm uzunluğunda 400nm çapında her biri 40nN çekim kuvvetine sahip tüycükler bulunur.
Bu tüycüklerin çekim kuvveti ıslak zeminde 6nN’a kadar düşerek 7 de 1 ine geriler. Geckolar ise tüycüklerinin arasındaki kanallardan suyu tahliye ederek çekim kuvvetini muhafaza edebilirler.

Tamamen tozlu ve çamurlu yüzeylerde gecko ayaklarının çekim kuvveti şaşırtıcı bir şekilde artmaktadır. Çünkü geckoların ayaklarına yapışan yabancı partiküller yüzeye daha da güçlü bir şekilde yapışır. Dolayısıyla geckoların ayaklarını temizlemeye ihtiyaçları yoktur.” Yani doğadan örnek alarak ürettiğimiz yapay malzeme orijinalinden henüz oldukça geridir.

Hangi Alanlarda Kullanılabilir
Stanford üniversitesinde yapılan bir AR-GE çalışmasında yapay gecko ayaklarını kullanan bir robot üretilmiştir. Bu robot düz duvara ve cam yüzeylere tırmanabilmektedir. Bu robotun arama kurtarma çalışmalarında ulaşılamayan noktalara girmesi hedefleniyor.
Bu robot diğer duvar tırmanan robotlara kıyasla daha iyi bir performans gösteriyor. “Diğer robotlar yapışkan kimyasal malzemeler veya vakum kullandıkları için daha yavaş ilerliyor ancak gecko robotu hızlı bir şekilde yüzeye yapışıp yüzeyden ayrılabiliyor. Yapay gecko ayakları hiç bir kimyasal içermediği için arkasında iz bırakmıyor.” Bir sonraki adımda Z-MAN projesiyle insanların duvara tırmanabilmesini sağlamak istiyorlar.
Stanford Üniversitesi’nde yürütülen bu proje göz önüne alındığında gecko teknolojisinin kullanım alanı olarak aklımıza ilk olarak robotlar ve askeri sanayi geliyor. Bunun yanında medikalden uzay teknolojisine birçok alanda daha kullanılabilir.
Örnek olarak TedYouth’un düzenlediği dizayn yarışmasında, Harry araba koltuklarını gecko yapışkan teknolojisiyle kaplayıp emniyet kemerini kaldırmayı teklif ederek ödül aldı.
Robert Langer ve Jeff Karp tarafından MIT Üniversitesi’nde yürütülen bir araştırmada gecko teknolojisi ile dokuya zarar vermeyen ama bir arada tutan medikal bandajların üretilmesi hedefleniyor.
Bunun dışında gecko teknolojisi “yer çekimsiz ortamlarda astronotların yürümesini kolaylaştırmak için” kullanılabilir.
Sonuç:
Bilim insanları doğada karşılaştıkları sorunların üstesinden yine doğada bulunan mükemmel çözüm örneklerini taklit ederek geliyorlar.
Kaynakça:
1- Van der Waals Kuvvetleri nelerdir?
https://byjus.com/chemistry/van-der-waals-forces/
2- Kendisi Zayıf, Etkisi Büyük: Moleküller Arası Etkileşimler
https://bilimgenc.tubitak.gov.tr/makale/kendisi-zayif-etkisi-buyuk-molekuller-arasi-etkilesimler
3- Johannes Diderik van der Waals Biyografik
https://www.nobelprize.org/prizes/physics/1910/waals/biographical/
4- Kendi Kendini Yetiştirmiş Bir Adam ve Modern Moleküler Bilimin Babası Johannes van der Waals’ın Doğumu
https://www.aps.org/publications/apsnews/202111/history.cfm
5- Kimyasal bağ nedir
https://www.elektrikrehberiniz.com/elektrik-trafolari/kimyasal-bag-nedir-13262/
6- Gecko Kertenkelesi ve Geckoları Taklit Eden Teknolojiler
https://www.fizikist.com/gecko-kertenkelesi-ve-geckolari-taklit-eden-teknolojiler
7- Van der Waals Kuvvetleri





