
Termodinamik enerjinin bilimi olarak tanımlanabilir ve enerji, değişikliklere neden olma yeteneği olarak düşünülebilir. Termodinamik; güç üretimi, soğutma ve maddenin özellikleri arasındaki ilişkileri içeren enerji ve enerji dönüşümlerinin tüm yönlerini barındıran bir anlam taşır.
Doğanın en temel yasalarından biri enerjinin korunumu ilkesidir. Bu yasa genel olarak, bir etkileşim sırasında enerjinin bir biçimden başka bir biçime dönüşebileceğini, fakat toplam miktarının sabit kalacağını belirtir.
Bu açıdan bakıldığında, enerji yaratılamaz ya da yok edilemez. Termodinamiğin yasaları evrenin büyük patlamayla beraber ilk oluşmaya başladığı andan beri mevcut olmalarına rağmen, 1697’de Thomas Savery ve 1712’de Thomas Newcomen’in İngiltere’de ilk başarılı atmosferik buhar makinalarını yapmalarına değin termodinamik bir bilim olarak ortaya konmamıştır.
Bu makinalar çok yavaş ve düşük verimli olmakla birlikte, yeni bir bilimin gelişmesinin önünü açmışlardır.

Yaşamsal aktivitelerde ihtiyaç duyulan işleri yapabilmek için gerekli olan enerji açığa çıkarma ve çıkarılan enerji ile istediğimiz hareketleri yapabilme amacı, Termodinamik Bilim’inin konusunu oluşturmaktadır.
Günümüzde halen, fosil yakıtlar dünyanın baskın enerji kaynağıdır.
Bu nedenle bu enerji kaynaklarına “birincil enerji kaynakları” denir. Ancak fosil yakıtların yakılması sadece termal enerji üretir. Ortaya çıkan termal enerjiyi ikincil enerji kaynağına (elektrik enerjisi vb.) dönüştürmek mümkündür.
Isı enerjisini başka bir enerji formuna dönüştürmek için ısı motoru (termik motor) kullanılmalıdır. Birçok ısı motoru, döngünün bir bölümünde ısı şeklinde enerji sağlayarak ve sağlanan bu enerjiyi döngünün başka bir bölümünde yararlı başka bir iş için kullanarak, döngüsel olarak çalışır.
Sistemi orijinal durumuna döndüren bir işlem döngüsel işlem olarak adlandırılır.
Bir döngünün sonunda, tüm özellikler başlangıçtaki ile aynı değere sahiptir. Tipik bir termodinamik döngü, bir sistemi orijinal durumuna geri getirmek için değişen basınç, sıcaklık ve diğer durum değişkenlerini değiştirirken ısı ve iş aktaran bir dizi termodinamik süreçten oluşur. Kapalı bir sistemin iç enerjisindeki artış, sisteme giren ısının yaptığı işten kaynaklanmaktadır.

Fiziksel ve kimyasal değişimlerde meydana gelen ısı değişimlerini inceleyen bilim dalına termokimya denir.
Enerjiyi ve enerji değişimleri sonucunda gerçekleşen olayları açıklayabilmek için termodinamik yasaları ortaya konulmuştur.
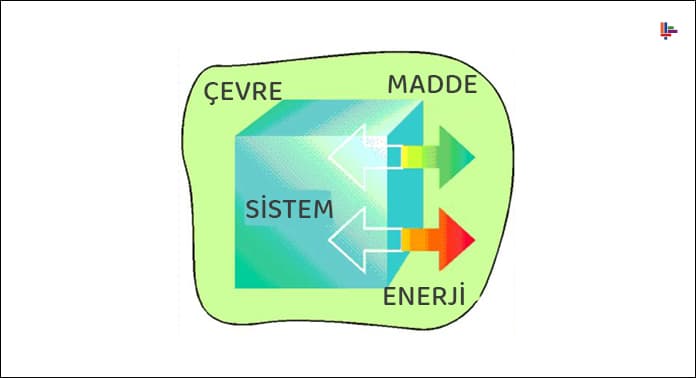
Sistem, evrenin incelenmek için seçilen belirli parçasıdır.
Ortam, evrenin sistem dışında kalan ve sistemle temas halinde olan kısmıdır. Evren ise sistem ve ortamı kapsar.
Sistemde meydana gelen sıcaklık, basınç ve hacim değişiklikleri ölçülebilir olmalıdır.
Sistem Çeşitleri
Açık Sistem; Ortam ile sistem arasında madde ve enerji alışverişi olan sistemlerdir. İnsan vücudu, ağaç yaprağı, ağzı açık bardaktaki çay açık sistem örnekleridir.
Kapalı Sistem; Ortam ile sistem arasında enerji alışverişi olan, madde alışverişi olmayan sistemlerdir. Pil ve ağzı kapalı şişedeki su kapalı sistem örnekleridir.
İzole Sistem; Ortam ile sistem arasında madde ve enerji alışverişi olmayan sistemlerdir. Termos bir izole sistem örneğidir.

İzokorik Sistem; Ortam ile sistem arasında enerji alışverişi olan ve hacmi sabit tutulan sistemlerdir. Düdüklü tencere bir izokorik sistem örneğidir.
İzotermal Sistem; Ortam ile sistem arasında madde ve enerji alışverişi olan ancak sıcaklığı sabit tutulan sistemlerdir. Klima, derin dondurucu ve yaklaşık 36,5oC’deki insan vücudu izotermal sistem örnekleridir.
İzobarik Sistem; Ortam ile sistem arasında madde ve enerji alışverişi olan ancak basıncı sabit tutulan sistemlerdir. İdeal pistonlu kaplar ve balonlar izobarik sistem örnekleridir.
İç Enerji; Bir sistemin sahip olduğu toplam enerjisidir.
İç Enerji = Potansiyel enerji + Kinetik enerji
İç Enerji (U) harfi ile gösterilir. Bu sistemin iç enerjisi ölçülemez, ancak iç enerjideki değişim (ΔU) ölçülebilir.
Termodinamik: enerji, ısı, iş ve sıcaklık arasındaki ilişki ele alan bilim dalıdır.
Basit bir ifadeyle termodinamik, enerjinin bir yerden başka bir yere ve bir biçimden başka bir biçime transferi ile ilgilenir.
Bu süreçteki anahtar kavram, ısının, belirli bir mekanik işe denk gelen bir enerji biçimi olmasıdır.
Termodinamik; güç üretimi, soğutma ve maddenin özellikleri arasındaki ilişkileri içeren enerji ve enerji dönüşümlerinin tüm yönlerini barındıran bir ifade taşır.
Tipik bir termodinamik döngü, ısı ve iş aktaran bir dizi termodinamik süreçten oluşur.
Genel olarak termodinamik, enerji üretimi, enerji depolanması, enerji transferi ve enerji dönüşümü bilimidir diyebiliriz.
Kimyasal tepkimelerin çok büyük bir kesiminde ısı enerjisinde bir değişim olmaktadır. Kimya biliminde bu durum ile ilgili olan konularla termokimya ilgilenir.
Termokimyanın ısı ve sıcaklık ile ilgili yasalarına, termodinamik yasaları denilmektedir. Enerji aktarımının gerçekleştiği olaylarda termodinamik yasaları geçerlidir. Termodinamik yasalarına geçmeden önce ısı ve sıcaklık kavramlarını inceleyelim.
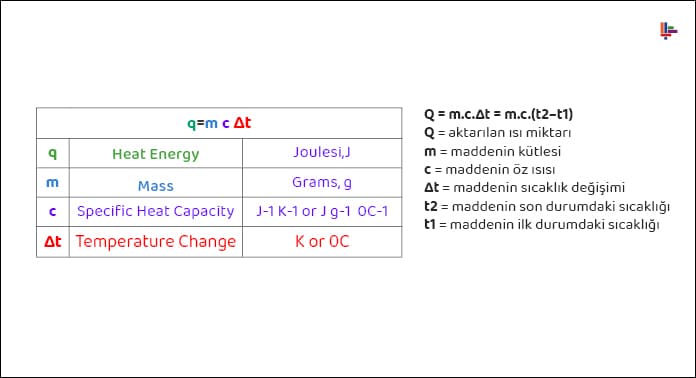
Isı ve Sıcaklık Kavramları
Sıcaklık, bir maddeyi oluşturan taneciklerin ortalama hareket enerjisidir.
Isı ise sıcaklık farkından dolayı iki madde arasında transfer edilen enerjinin adıdır.
Sıcaklık bir enerji değildir. İki maddenin sıcaklıkları farklı olması halinde sıcak olan maddeden soğuk olan maddeye ısı geçişi olur ve bu ısı geçişi iki maddenin sıcaklıkları eşitleninceye kadar devam eder.
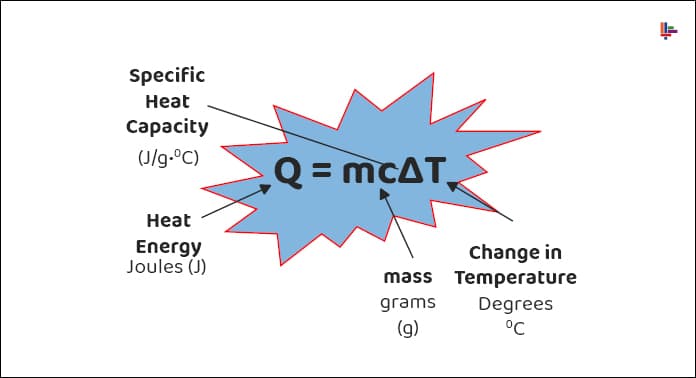
Sıcaklık termometre ile ölçülür ve ölçüm aletinin sonucuna göre birimlere sahiptir. Isının birimi ise joule veya kalori (cal) dir. Bir maddenin sahip olduğu toplam ısı direkt olarak bir ölçüm cihazıyla ölçülemez; ancak matematiksel olarak aktarılan ısı hesabı yapılabilir.
Termodinamik bilimi; insanların bu daha fazla enerji ve güç elde etme çalışmalarında boşa emek, kaynak ve zaman kaybı yaşamamaları için dört temel yasa ortaya koymuştur. Isı ile enerji ve güç elde etmek isteyenler bu yasaları mutlak suretle dikkate almalıdır. Zira, farkında olmasa da olmasa da enerji üretim ve kullanım süreçlerinde bu yasalar olaylara yön vermektedir.
Termodinamik değişkenler: Bu değişkenler genellikle sistemin ya kendisini ya da çevre koşullarını tarif etmek için kullanılır. En çok kullanılanlar ve simgeleri şunlardır:
Mekanik değişkenler:
İstatistiksel değişkenler:
Bilindiği gibi sayma sayıları birden başlamaktadır. Buna rağmen, termodinamik yasalarının birden değil de sıfırdan başlamasının sebebi, bu yasanın birinci ve ikinci kanunlarının ortaya konmasından yarım yüzyılı aşkın bir süre sonra anlaşılabilmesidir.
Termodinamik, özellikle fizikokimya, kimyasal mühendislik ve mekanik mühendislik olmak üzere, bilim ve mühendislikte pek çok konuya açıklık getirir.
Termodinamik, toplamda dört adet yasadan oluşmaktadır.
- termodinamiğin sıfırıncı yasası
- termodinamiğin birinci yasası
- termodinamiğin ikinci yasası
- termodinamiğin üçüncü yasası
Termodinamiğin Sıfırıncı Yasası
Bu kanun ilk olarak 1931 yılında R. H. Fowler tarafından ortaya konmuştur. Bilindiği gibi, yüksek ısılı yerden düşük ısılı yere doğru daima bir geçiş söz konusudur. Bu olgudan hareketle, Termodinamiğin Sıfırıncı Yasası, “termal denge” kavramına dayanmaktadır ve şu temel yargı ile ifade edilmektedir:
“İki ayrı cisim bir üçüncü cisimle ısıl dengede ise birbirleriyle de ısıl dengededir.”
Bu ifade, temas halinde olan cisimlerin ısı alış verişinde bulunduklarını ve belirli bir süre sonunda da termal dengeye gelerek aynı sıcaklıklara sahip olacaklarını söylemektedir.
A ve B sistemleri birbirleri ile ısıl dengede olduğunda, A sistemi ile ısıl dengede olan bir C sistemi B sistemi ile de ısıl denge durumundadır. (TA = TB = TC)
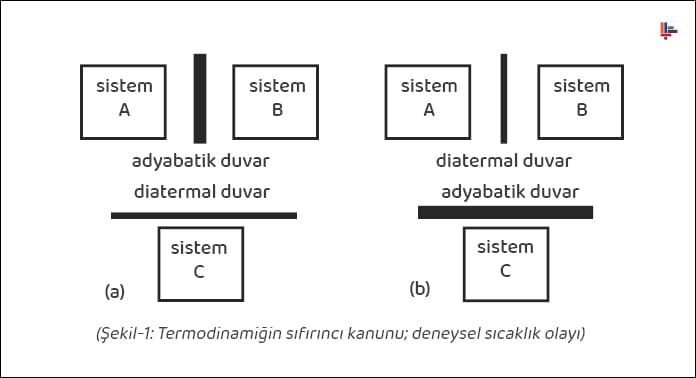
Sıfırıncı kanun, termodinamiğin en önemli kavramı olan deneysel sıcaklık olayını açıklayan bir kanundur.
Bir A sistemi net enerji transferi olmaksızın bir B sistemiyle temasta ise, bu iki sistem termal dengededir. Şekil-1(a)’da adyabatik bir duvarla birbirinden ayrılmış olan A ve B sistemi (net enerji transferi yoktur), enerji transferine izin veren diatermal bir duvarla C sistemiyle temas halindedir. Bu aşamadan sonra, A ve B sistemi arasında, Şekil-1(b)’de görüldüğü gibi diatermal duvarla bir temas sağlandığında, aralarında net ısı transferi olmaksızın termal denge oluşacaktır.
Termodinamiğin Birinci Yasası
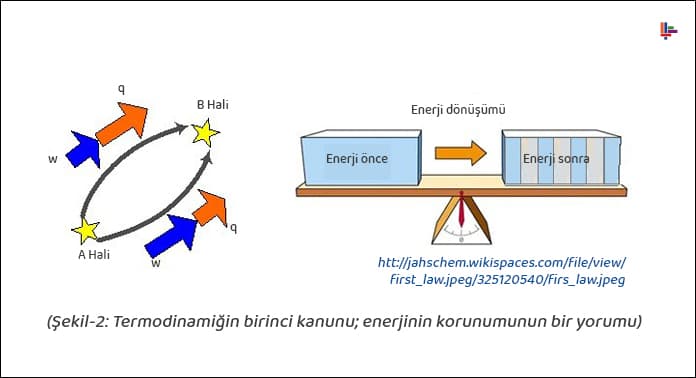
Termodinamiğin birinci kanunu, enerjinin korunumu kanununun bir versiyonu, yani yorumudur. Yoktan enerji üretmek ya da var olan enerjiyi yok etmek için yapılan çalışmaların başarısızlıkla sonuçlanmasının ardından birinci yasa ortaya çıkmıştır. Yapılan deneyler sonucunda, kütle gibi enerjinin de korunduğu sonucuna ulaşılmıştır.
Termodinamiğin Birinci Yasası, şu temel yargı ile ifade edilmektedir:
“Enerji var iken yok, yok iken de var edilemez, ancak bir halden diğer bir hale dönüştürülebilir.”
Enerjinin korunumu kanunu, izole bir sistemin toplam enerjisinin sabit olduğunu, enerjinin bir formdan diğer bir forma dönüşebileceğini, fakat yaratılamayacağı veya yok edilemeyeceğini söyler.
Birinci kanun çoğu zaman, kapalı bir sistemin iç enerjisindeki değişikliğin, sisteme verilen ısı miktarı ile sistem tarafından çevresine yapılan iş miktarı arasındaki fark olarak formülendirilir. Yani, birinci tür sürekli çalışan bir makine (enerji girişi olmaksızın iş üreten) yapılması olanaksızdır.
“İzole bir sistemde enerji korunur. Enerji, yoktan var edilemez; var olan enerji de yok edilemez; sadece bir şekilden diğerine dönüşür”.
Bir sistemin iç enerjisindeki değişim: sisteme verilen ısı ile, sistemin çevresine uyguladığı iş toplamıdır.
İşin ısıya dönüşümü Benjamin Thomson (1753-1814) ve James Prescott Joule (1818-1887) tarafından nicel olarak incelenmiştir. Diğer enerji türlerinin tümüyle ısıya dönüştüğünü deneysel olarak gösteren Joule, 1840 yılında 1 cal’lik ısının 4,184 J değerindeki işe eşit olduğunu bulmuştur.
Birinci yasa içinde iç enerji (U) ve entalpi (H) hal fonksiyonları yer alır. Bu değerler ile enerjinin niceliği ortaya koyulur. Birinci yasa ile elde edilen verim değerleri ise sistemin termal verimi ifade etmektedir.
dU = dq + dw
DU = q + w
dU, DU = sistemin iç enerji değişimi,
dq, q = sistem içinde ısı transferi,
dw, w = sistem üzerinde yapılan iş (İş = kuvvet x yol)
Eşitlik, bir sistemin iç enerji değişikliğini tanımlar; iç enerji bir hal fonksiyonudur.
Termodinamiğin İkinci Yasası
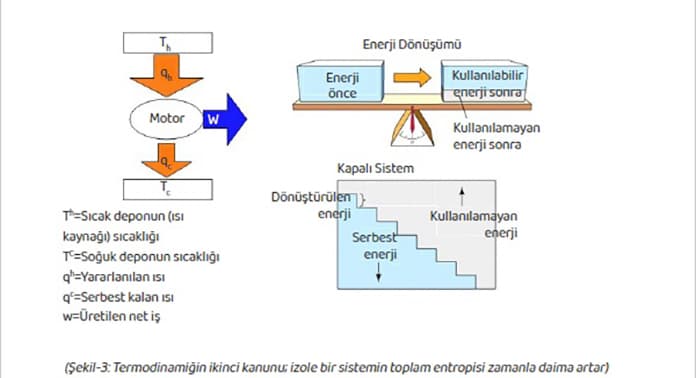
Birinci yasa, enerjinin miktarı ve korunumunu ortaya koyarken ikinci yasa, enerjinin işe dönüşebildiği kısmı yani kalitesini ele almaktadır.
Termodinamiğin İkinci Yasası, hal değişimlerin herhangi bir yönde değil, belirli bir yönde gerçekleşeceğini söyler. Termodinamiğin Birinci ve İkinci Yasası’nı sağlamayan bir hal değişimi gerçekleşemez.
Enerji, daima kendini yok etme eğilimindedir. Yani, yüksek potansiyellere ulaşan enerji, kendini daha düşük yoğunluğa sahip başka bir enerji formuna dönüştürme eğilimindedir.
Termodinamiğin İkinci Yasası, gerçekleşen olayların entropiyi artıracak yönde (enerji miktarının azalması yönünde) gerçekleştiğini ifade etmektedir. Doğadaki bütün olaylar ikinci yasaya nedeniyle gerçekleşir.
Termodinamiğin İkinci Yasası şu temel yargıyı ortaya koymaktadır:
“Enerjinin tamamı faydalı işe çevrilemez, bir kısmı sistemin içsel bütünlüğünü korumak için kullanılır.”
İkinci yasaya göre, herhangi bir süreçte bir sistem ve çevresindeki entropi değişimi ya “sıfır” yada “pozitiftir”. Yani evrenin entropisi sürekli artma eğilimindedir. Bu durumda, ikinci yasaya göre evrendeki hem enerji hem de madde zaman ilerledikçe daha az faydalı iş yapabilir hale gelmektedir.
Bir sistemin enerjisi ne kadar fazla ise o kadar fazla iş yapılabilir. Bununla birlikte, bir sistemin sahip olduğu enerjinin tümü iş yapmada kullanılamaz; bir kısım enerji sistemin içsel bütünlüğünün korunması için saklanır. Bu durumda iş yapabilmede kullanılan enerji genellikle serbest enerji olarak adlandırılır. Serbest enerji, bazen ekserji (exergy) olarak da adlandırılır.
Termodinamiğin ikinci kanunu, izole bir sistemin toplam entropisinin zamanla daima artığını; veya sistemin kararlı halde olduğu veya reversibil bir proses varlığında sabit kaldığını ifade eder.
Entropideki artış doğal proseslerin irreversibilitesinden (dönüşümsüz), ve gelecek ve geçmiş arasındaki asimetriden kaynaklanır. Tarihsel olarak, ikinci kanun deneysel bulgulara dayanır ve termodinamik teorinin bir kanıtı olarak kabul edilmiştir. Statistik termodinamik, klasik veya kuantum, kanunun mikroskobik orijinini açıklar.
Kelvin: “Bir rezervuarı ısısını absorblayarak tümüyle işe dönüştürebilen bir proses olanaksızdır.” Başka bir deyişle, “|w| < qh dir ve ısı motorunun verimi mutlaka %100’den küçüktür”. Bir ısı motoru ısıyı işe dönüştürür.
Clausius: “Soğuk bir cisimden sıcak bir cisme ısı akışı dışında bir etkisi olmayan bir işlem elde etmek imkânsızdır”. Entropi (S º dqrev/T) bir hal fonksiyonudur.
dS ³ dq/T (clausius eşitsizliği):
dS = dq / T (tersinir değişim)
dS > dq / T (tersinmez değişim)
İzole sistemler için:
dS = 0 (tersinir değişim)
dS > 0 (tersinmez değişim)
Termodinamiğin Üçüncü Yasası
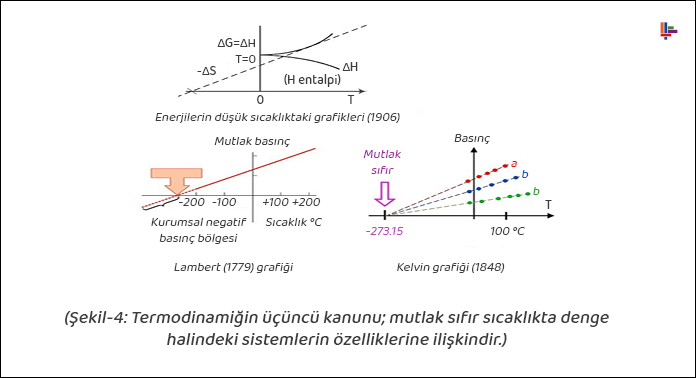
Termodinamiğin üçüncü kanunu, mutlak sıfır sıcaklığındaki maddelerin entropisi ile ilgilidir ve esas olarak mükemmel bir kristal maddenin mutlak sıfır sıcaklığındaki (-273°C) entropisinin sıfır olduğunu ifade eder. Bu kanunla entropi için başlangıç değer şartları belirlenir.
Mutlak sıfır, bir cismin keyfi olarak yakınlaşabileceği, ancak asla erişemeyeceği bir sıcaklıktır. Laboratuarda 2,0 x 10-8 K kadar düşük sıcaklıklar elde edildi, ancak mutlak sıfıra ulaşılamadı.
Termodinamiğin Üçüncü Yasası şu temel yargıyı ifade etmektedir:
“Bir nesnenin sıcaklığını sonlu sayıda aşamada mutlak sıfıra indirmek olanaksızdır.”
Termodinamiğin üçüncü kanunu, mutlak sıfır sıcaklıkta denge halindeki sistemlerin özelliklerine ilişkindir ve örneğin, şöyle tanımlanabilir: “mükemmel bir kristalin mutlak sıfırdaki entropisi tam olarak sıfırdır”. Mutlak sıfırda (sıfır Kelvin) sistem minimum enerjili halde olmalıdır; üçüncü kanuna göre, mükemmel kristal sadece bir minimum enerji haline sahiptir.
Entropi bulunan mikrohallerin sayısıyla ilişkilidir; çok sayıda partikül içeren bir sistem için kuantum mekaniği, minimum enerjili sadece tek bir temel hal olduğunu belirtir. Sistem iyi tanımlanmamış bir düzende ise (örneğin, düzenlenme camsı olduğunda), sistem çok düşük sıcaklıklara taşınırken bir miktar sonlu entropili partikül bulunur; bu sonlu değere sistemin kalıntı entropisi denir.
“Sıcaklık mutlak sıfıra yaklaştıkça bütün hareketler sıfıra yaklaşır.”
Bu yasa neden bir maddeyi mutlak sıfıra kadar soğutmanın imkansız olduğunu belirtir:
Nernst Isı Teoremi: T ® 0 iken DS®0 olduğuna göre, bir elementin saf kristalin haldeki entropisi, T = 0 Kelvinde sıfırdır.
Bu nedenle herhangi bir kusursuz kristalin maddenin entropisi, T = 0 Kelvinde sıfır olur. Nernst ısı teoremine diğer bir bakış Gibbs serbest enerjisi (G) yoluyla yapılabilir; buna göre:
Sabit sıcaklık ve basınçta reaktantların ürünlere dönüşümü için Gibbs serbest enerji:
Δ G = Δ H − T Δ S
T = 0 sınırında, ΔG = ΔH ΔG eğrisinin eğimi: –ΔS’dir.
T → 0 eğim → 0 dolayısıyla: ΔS → 0 olur
Sıcaklık Ölçekleri:
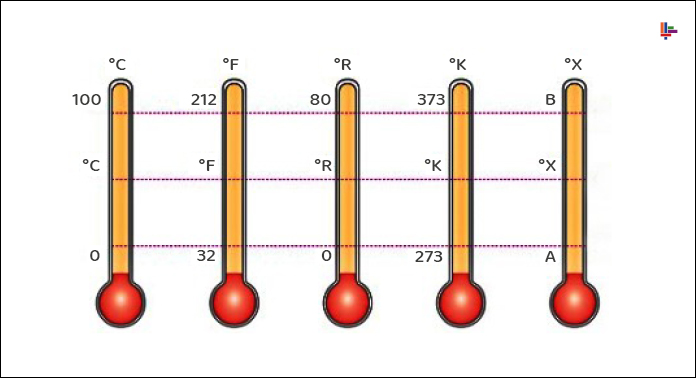
Sıcaklık değerlerinin ortak bir dille ifade edilebilmesi için sıcaklık ölçeklerine veya skalalarına gerek duyulur. Günümüze kadar değişik sıcaklık ölçekleri kullanılmıştır. Tüm sıcaklık ölçekleri suyun donma ve kaynama noktaları gibi, kolayca elde edilebilir sıcaklık değerlerine dayanır.
Bu değerlere sırasıyla donma noktası ve buhar noktası adı da verilir. Buz noktası bir atmosfer basınçtaki doymuş havayla su-buz karışımının denge halinde bulunduğu sıcaklıktır. Buhar noktası ise bir atmosfer basınçtaki doymuş sıvı buhar karışımı suyun sıcaklığıdır.
Günümüzde SI birim sisteminde kullanılan sıcaklık ölçeği Celcius ölçeğidir. Daha önce Santigrad (Centigrade) ölçeği olarak bilinen bu ölçek, 1948 yılından başlayarak, ölçeği bulan isveçli uzay bilimcisi A. Celcius’un (1701-1744) adıyla anılmıştır.
İngiliz birimlerinde kullanılan sıcaklık ölçeği Fahrenheit ölçeğidir. Alman deney aleti yapımcısı G. Fahrenheit’m (1686-1736) adıyla anılmaktadır.
Celcius ölçeğinde buz ve buhar noktalarına sırasıyla 0 ve 100 °C değerleri verilmiştir.
Buz ve buhar noktaları Fahrenheit ölçeğinde sırasıyla 32 ve 212 °F değerlerini alır.
Bu ölçekler çoğu zaman iki noktalı ölçekler diye adlandırılır.
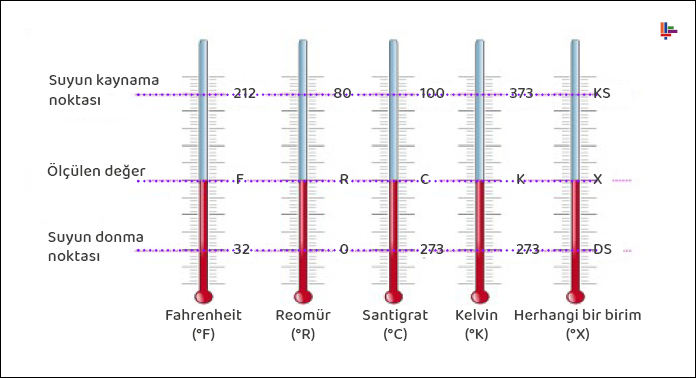
Termodinamikte, madde veya maddelerin özeliklerinden bağımsız bir sıcaklık Ölçeğinin kullanılması istenir. Bu tür bir sıcaklık ölçeği, termodinamiğin ikinci yasasıyla ilişkili olarak geliştirilen termodinamik sıcaklık ölçeğidir.
SI birimlerinde termodinamik sıcaklık ölçeği, Lord Kelvin’in (1824-1907) adıyla anılan Kelvin ölçeğidir.Bu ölçekte sıcaklık birimi Kelvin’dir ve K ile (°K değil) gösterilir. Kelvin ölçeğinde en düşük sıcaklık 0 K’dir. Alışılagelmiş soğutma yöntemlerinin dışında yöntemler kullanarak bilim adamları mutlak sıfır kelvin sıcaklığına yakın değerler elde edebilmişlerdir (1989 yılında 0.000000002 K).
İngiliz birim sisteminde termodinamik sıcaklık ölçeği, William Rankine’in (1820-1872) adıyla anılan Rankine ölçeğidir. Bu ölçekte sıcaklık birimi rankin olup, kısaltılmış olarak R ile gösterilir.
Kelvin ölçeği ile eşdeğer bir sıcaklık ölçeği de mükemmel gaz sıcaklık ölçeğidir. Bu ölçekte sıcaklıklar sabit-hacimli gaz termometresi ile ölçülür. Bu termometre düşük basınçta bir gazla doldurulmuş sabit hacimli bir kaptır. Kullanılan gaz genellikle hidrojen veya helyumdur. Termometre, düşük basınçlarda, hacmi sabit olan bir gazın sıcaklığının basınçla orantılı olduğu ilkesine dayanır. Başka bir deyişle, yeterince düşük basınçlarda sabit hacimde bir gazın sıcaklığı basınçla doğrusal bir değişim gösterir. Bu durumda gazın sıcaklığı ve basıncı arasındaki ilişki aşağıda verilmiştir.
[ T = a + bP ]
Burada a ve b gaz termometresi için deneysel olarak belirlenmiş katsayılardır, a ve b belirlendikten sonra ortamın sıcaklığı, gaz termometresini ortama daldırıp, ısıl denge sağlandığında gaz basıncını ölçerek yukarıdaki bağıntıdan hesaplanır.
Özetle; Termodinamik, ısının enerji ve faydalı iş olarak tanımladığımız fiziksel olgularla ilişkisini inceleyen doğa bilimidir.
Termodinamik sistemler makroskopik olgularla -ısı, enerji ve sıcaklık gibi tanımlanır.
Termodinamik mikroskobik sistemlerle uğraşan alt dalları olmasına rağmen, genel olarak maddenin mikroskobik bileşenleriyle uğraşmaz. Termodinamik yasalar bu makroskopik olguları tanımlar, bu olguların değişik şartlar altında nasıl davrandığını inceler ve bu davranışların sınırını çizer.
Bir başka deyişle, popüler bilim yazarlarının en çok karşılaştığı sorulardan ikisi olan “devridaim makinesi yapmak olanaklı mı?” ve “mutlak sıfıra ulaşılabilir mi?” sorularına gönül rahatlığı ile “hayır” cevabı vermesini sağlar.
Görüşmek dileğiyle…
Kaynakça:
1- Termodinamik Yasaları ve Kavramlar
https://muhendis.web.tr/termodinamik-yasalar-kavramlar/
2- Termodinamik Yasaları Nelerdir?
https://www.enerjiportali.com/termodinamik-yasalari-nelerdir/
3- Termodinamik Yasaları ve Sonuçları
https://bikifi.com/biki/termodinamik-yasalari-ve-sonuclari/
4- Sistemler ve Enerji Türleri
https://www.eokultv.com/sistemler-ve-enerji-turleri-kimya-ayt/41819
5- Termodinamik Yasalar
http://bilsenbesergil.blogspot.com/p/termodinamik-kanunlar-laws-of.html
6- Evrenin Termodinamiği
https://www.bilimkurgukulubu.com/genel/bilim-teknoloji/evrenin-termodinamigi-1-termodinamik/
7- Termodinamiğin Sıfırıncı Yasası
https://www.muhendisbeyinler.net/termodinamigin-sifirinci-yasasi/
Aşşağıda linkini paylaştığımız , Tübitak tarafından hazırlanan konuyla alakalı pdf ilginizi çekebilir..
https://e-dergi.tubitak.gov.tr/edergi/yazi.pdf?dergiKodu=4&cilt=46&sayi=791&sayfa=58&yaziid=33985





